Se știe de mult că toate moleculele au două sarcini egale și opuse, care sunt separate printr-o anumită distanță. În cazul unor astfel de molecule polare, centrul de sarcină negativă nu coincide cu centrul de sarcină pozitivă. Mărimea polarității în astfel de molecule covalente poate fi descrisă prin termenul Dipole Moment, care este în esență măsura polarității într-o legătură covalentă polară.
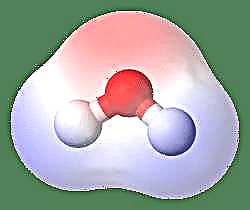
Cel mai simplu exemplu de dipol este o moleculă de apă. O moleculă de apă este polară din cauza împărțirii inegale a electronilor săi într-o structură „îndoită”. Molecula de apă formează un unghi, cu atomi de hidrogen la vârfuri și oxigen la vârf. Deoarece oxigenul are o electronegativitate mai mare decât hidrogenul, latura moleculei cu atomul de oxigen are o sarcină negativă parțială, în timp ce hidrogenul, în centru, are o încărcare parțială pozitivă. Din această cauză, direcția momentului dipol indică spre oxigen.
În limbajul fizicii, momentul dipolului electric este o măsură a separării sarcinilor electrice pozitive și negative într-un sistem de sarcini, adică o măsură a polarității generale a sistemului de sarcină - adică a separării încărcăturii electrice a moleculelor, care duce la un dipol. Din punct de vedere matematic și, în cazul simplu, a două sarcini punctuale, una cu sarcină + q și alta cu sarcină? Q, momentul dipolului electric p poate fi exprimat ca: p = qd, unde d este vectorul de deplasare care indică de la sarcina negativă către incarcatura pozitiva. Astfel, vectorul de moment dipol electric punctează de la sarcina negativă la sarcina pozitivă.
Un alt mod de a-l privi este reprezentarea momentului dipol prin litera greacă m, m = ed, unde e este sarcina electrică și d este distanța de separare. Se exprimă în unitățile Debye și se scrie ca D (unde 1 Debye = 1 x 10-18e.s.u cm). Un moment dipol este o cantitate vectorială și, prin urmare, este reprezentat de o săgeată mică, cu o coadă la centrul pozitiv și cu capul îndreptat spre un centru negativ. În cazul unei molecule de apă, momentul dipolului este 1,85 D, în timp ce o moleculă de acid clorhidric este 1,03 D și poate fi reprezentată ca:
Am scris multe articole despre moment dipol pentru Space Magazine. Iată un articol despre ce este făcută apa și iată un articol despre molecule.
Dacă doriți mai multe informații despre momentul dipolului, consultați aceste articole din Hyperphysics și Science Daily.
Am înregistrat, de asemenea, un întreg episod al distribuției de astronomie despre Molecule în spațiu. Ascultă aici, episodul 116: Molecule în spațiu.
surse:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule